2024年3月8日,nb88新博唯一官网生物化学与分子生物学系研究生赵雪枫同学和团队成员在国际著名期刊The Journal of Biological Chemistry(Nature指数期刊、美国生物化学与分子生物学学会会刊)发表题为“去泛素化酶 OTUB1 通过稳定 YTHDF2 蛋白介导PRSS8 mRNA 降解促进前列腺癌细胞增殖”(YTHDF2 protein stabilization by the deubiquitinase OTUB1 promotes prostate cancer cell proliferation via PRSS8 mRNA degradation) 的研究论文,揭示了OTUB1调控YTHDF2蛋白稳定性介导PRSS8 mRNA 降解参与前列腺癌进展的新机制。

前列腺癌是男性泌尿系统最常见的恶性肿瘤之一,我国前列腺癌的发病率与病死率呈逐年上升趋势。m6A是RNA甲基腺嘌呤上发生的甲基化修饰,多种恶性肿瘤的发生发展与异常的m6A修饰密切相关。YTHDF2作为最早发现的m6A修饰阅读蛋白,主要介导m6A mRNA的稳定性,也是潜在的肿瘤治疗靶点。在RNA处理方面,YTHDF2通过C端识别结合m6A mRNA,而其N端则招募多种调控mRNA稳定性的蛋白复合物,启动不同的mRNA处理途径。在蛋白修饰方面,YTHDF2上可发生泛素化、SUMO化、磷酸化等多种翻译后修饰,这些修饰给予YTHDF2更多的功能复杂性。虽然YTHDF2在多种肿瘤中异常高表达,但是其机制及功能仍待进一步探究。
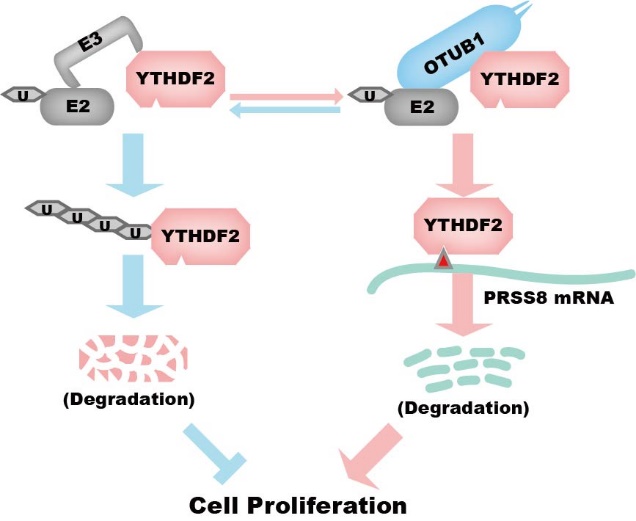
赵雪枫同学所在团队长期致力于表观遗传修饰相关蛋白质在肿瘤中的生物学功能研究。在该研究中,赵雪枫同学等人通过生物信息学分析、体内和体外生化实验和增殖表型检测揭示了YTHDF2在前列腺癌中的功能与作用机制。该研究首先通过分析质谱数据与Co-IP实验筛选出与YTHDF2可能互作的蛋白,结果显示在前列腺癌中YTHDF2与OTUB1有互作。又通过蛋白稳定性检测及一系列体内和体外泛素化与去泛素化反应,发现OTUB1是YTHDF2的新的去泛素化酶,但是OTUB1不是直接去除YTHDF2上的泛素化,而是通过非经典途径,即抑制E2与底物结合,从而抑制YTHDF2的泛素化。在功能方面,作者通过基因表达操作和一系列细胞增殖实验,证明OTUB1通过增加YTHDF2的蛋白稳定性促进前列腺癌细胞增殖表型。作者又通过生信与meRIP测序数据分析,筛选可能的YTHDF2下游基因,并通过基因表达操作、RIP和meRIP等实验鉴定出YTHDF2的下游靶标PRSS8。接下来,作者通过细胞增殖实验及临床样本验证发现PRSS8 抑制前列腺癌细胞的增殖表型。作者还进一步通过生信分析和细胞亚定位相关实验发现E-Cadherin/β-Catenin与 PRSS8 的表达相关,在功能上,PRSS8 能促进前列腺癌细胞的上皮形态转化,增加质膜上的 E-Cadherin定位,降低细胞核中的β-Catenin定位,从而抑制细胞恶性表型。最后,作者通过基因表达操作和一系列细胞增殖实验,进一步验证PRSS8 是 OTUB1-YTHDF2 调节轴的一个关键因子。综上所述,该研究揭示了OTUB1-YTHDF2-PRSS8调控轴在前列腺癌中的作用机理,OTUB1与YTHDF2互作并抑制其泛素化降解,从而影响下游抑癌靶标PRSS8 mRNA稳定性,进而促进前列腺癌细胞增殖。此研究深化了对YTHDF2在前列腺癌中作用机制的理解,对于开发针对YTHDF2的前列腺癌治疗途径提供了新的策略。
生物化学与分子生物学系研究生赵雪枫为该论文的第一作者,赵雪枫同学在读期间多次获得“华中科技大学知行优秀奖学金”、“红安惠农博士生奖学金”、“华中科技大学三好研究生”等荣誉。生物化学与分子生物学系宋檀婧和孙立栋老师为该论文的共同通讯作者。该研究得到了国家自然科学基金的支持。

 学院官方微信
学院官方微信
