
通过筛查哺乳动物细胞核内蛋白质修饰图谱,华中科技大学nb88新博唯一官网、细胞架构研究中心王玉刚教授团队和山东大学刘珂教授团队合作研究发现酪氨酸硫酸化修饰是组蛋白翻译后修饰的新类型,于2023年2月20日在 Nature Chemical Biology 发表题为Histone tyrosine sulfation by SULT1B1 regulates H4R3me2a and gene transcription的研究论文。该研究揭示了硫酸转移酶SULT1B1用PAPS为底物直接催化组蛋白H3Y99位点的硫酸化修饰(H3Y99sulf),阐明了H3Y99sulf通过招募PRMT1并调控组蛋白H4R3me2a和基因转录的功能机制。该工作既是组蛋白翻译后修饰类型的新发现,也是蛋白质硫酸化修饰研究领域的新拓展。
组蛋白(Histone)是染色质的主要蛋白质组分,作为DNA缠绕的骨架,与DNA共同组成核小体结构,并在遗传信息表达等染色质相关的生物学过程中发挥重要作用。正常生理条件下,组蛋白翻译后修饰(Post-Translational Modification, PTM)是核小体结构和功能的重要调节机制,在基因表达、DNA复制、DNA损伤修复和染色质结构调节等过程中起重要作用。病理生理条件下,组蛋白翻译后修饰的失调与癌症等人类重大疾病的发生与发展过程密切相关。蛋白翻译后修饰的相关研究既是生命过程调控规律的重要探索,也是重大人类疾病防治新策略的重要理论基础。
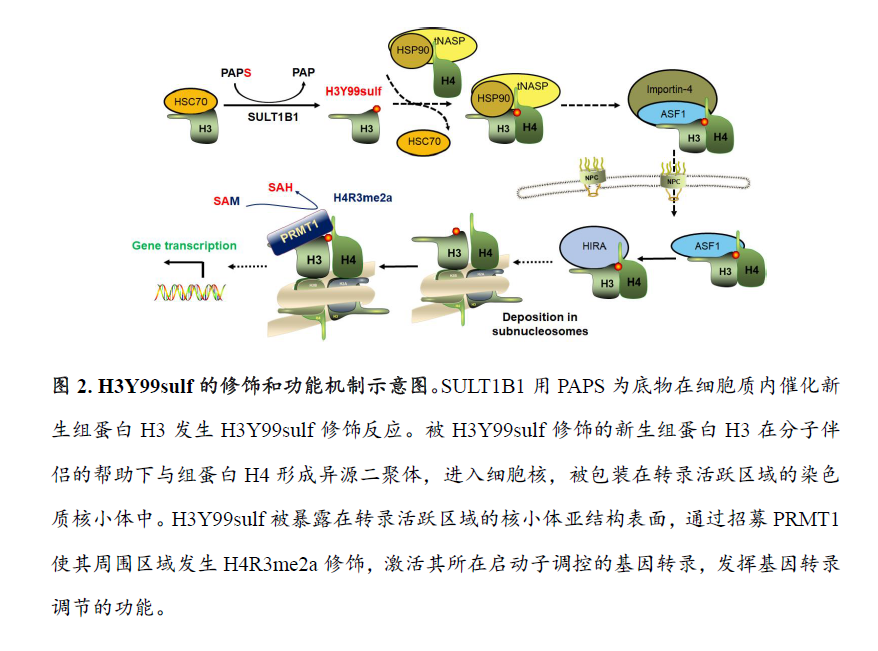
团队首先用高分辨蛋白质质谱分析纯化的细胞核提取物,发现组蛋白H3第99位酪氨酸残基附近肽段有两种分子量偏移。它们序列相同且荷质比相近,但液相色谱保留时间和二级质谱存在明显差异的水解肽段。通过数据库比对确定其中一条多肽来源于组蛋白H3Y99磷酸化修饰,另外一条多肽疑似来源于组蛋白H3Y99硫酸化修饰(H3Y99sulf)。通过与化学合成的H3Y99sul标准多肽进行分析比对,团队验证了Ysulf是尚未被报道的新型组蛋白修饰类型。通过定制的修饰位点特异的抗体,该团队进一步证明了H3Y99sulf是在多种真核细胞中染色质启动子区域广泛存在于的组蛋白修饰标签(histone mark)。通过筛选,细胞质硫基转移酶家族(SULTs)成员SULT1B1被确定为H3Y99sulf的主要调控蛋白:SULT1B1在细胞质内直接用PAPS为底物催化新生组蛋白H3单体的H3Y99sulf修饰。被H3Y99sulf修饰的新生组蛋白H3在分子伴侣的帮助下与组蛋白H4形成异源二聚体,进入细胞核,在转录活跃区域被包装入染色质核小体。
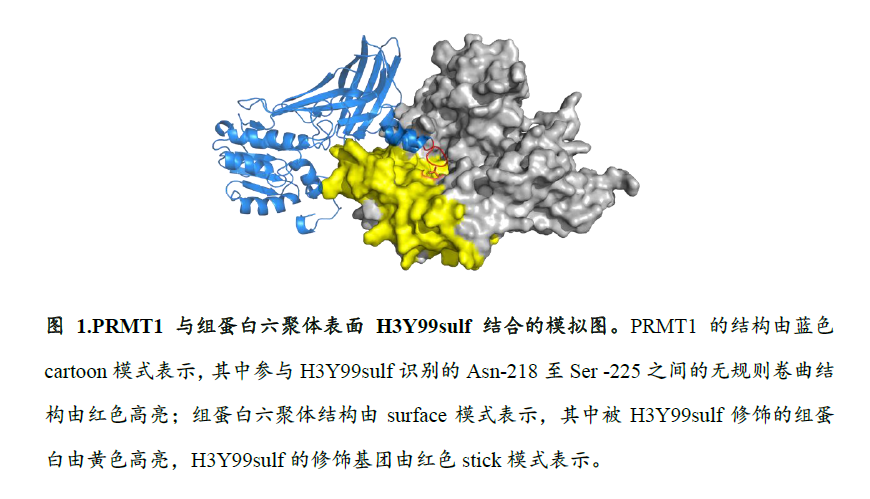
组蛋白H3Y99位点被包埋在核小体八聚体内部。H3Y99sulf修饰的组蛋白H3被组装在转录活跃区域的核小体,该区域大量的核小体由于基因转录的需要而处于六聚体、四聚体、半核小体等亚结构状态,以便RNA聚合酶沿着基因组DNA滑动并读取遗传信息。基于如上结构基础,H3Y99sulf被暴露于上述核小体亚结构的表面,可通过招募功能性识别因子而发挥下游功能。本团队通过筛选发现蛋白质精氨酸甲基转移酶(Protein Arginine Methyltransferase 1, PRMT1)是H3Y99sulf修饰的特异性识别蛋白。PRMT1通过其第218位天冬氨酸残基(Asn-218)至225位丝氨酸残基(Ser -225)之间的无规则卷曲结构识别并结合核小体亚结构表面的H3Y99sulf修饰标签(图1),以此被招募到细胞内染色质转录活跃区域,调控该区域组蛋白H4第3位精氨酸残基的不对称双甲基化修饰(Histone H4 arginine-3 asymmetry di-methylation, H4R3me2a),激活下游基因的转录,执行H3Y99sulf调控基因转录的功能(图2)。
该研究率先发现了酪氨酸硫酸化修饰是一种新型组蛋白修饰类型,鉴定了催化组蛋白H3Y99sulf的转移酶SULT1B1并阐明了修饰机制,发现了H3Y99sulf通过招募PRMT1而调控下游H4R3me2a修饰的功能机制,描绘了H3Y99sulf在染色质上的分布规律,阐明了H3Y99sulf调控基因表达和重要细胞信号通路的生理功能。工作拓展了真核生物组蛋白修饰图谱,进一步丰富了不同组蛋白修饰类型之间通过互作调控遗传信息表达的功能网络,为研究细胞核内其它蛋白质的硫酸化修饰提供了重要参考。
论文第一完成单位为华中科技大学nb88新博唯一官网,博士研究生余维星、周润心为共同第一作者,王玉刚教授、刘珂教授为共同通讯作者。该研究获得国家自然科学基金面上项目、重大研究计划(培育项目)等项目的资助。

 学院官方微信
学院官方微信
