2024年3月1日,华中科技大学同济医学院nb88新博唯一官网药理学系方超教授团队在美国心脏学会期刊Arteriosclerosis, Thrombosis, and Vascular Biology发表题为“Endoplasmic Reticulum Protein 72 Regulates Integrin Mac-1 Activity to Influence Neutrophil Recruitment”的研究论文,揭示了细胞外 ERp72通过催化二硫键重排调控整合素Mac-1活性从而影响中性粒细胞募集的分子机制,为治疗中性粒细胞相关血管病变提供了新靶点。

中性粒细胞募集到炎症部位需要从血管床内“渗出Extravasation”,该过程经历四个步骤:“滚动Rolling”、“粘附Adhesion”、“爬行Crawling”和“穿越Transmigration”,分别由选择素Selectins和整合素Integrins等粘附分子介导。整合素巨噬细胞-1抗原(Macrophage-1 antigen,Mac-1)是介导中性粒细胞招募的重要分子,活化的Mac-1与内皮细胞表面的配体结合,促进中性粒细胞在内皮表面粘附、爬行和迁移。但中性粒细胞整合素活化的调控机制,目前尚不完全清楚。
整合素的活化伴随着胞外段二硫键重排诱导的蛋白构象变化。巯基异构酶是一类催化蛋白质二硫键断裂、形成和异构化的酶,在稳定蛋白构象和调控生物活性等过程中发挥重要作用。内质网蛋白72(Endoplasmic reticulum protein 72,ERp72)是巯基异构酶家族的重要成员,在中性粒细胞表面高表达。
在本研究中,方超教授团队采用骨髓移植术构建了髓系ERp72敲除小鼠(BM Erp72-/-)。通过微血管荧光活体成像和体外黏附实验,发现Erp72-/-中性粒细胞存在整合素Mac-1介导的黏附/爬行缺陷,提示ERp72在Mac-1活化过程中发挥关键作用。进一步的机制研究发现,中性粒细胞表面ERp72和Mac-1在细胞膜脂筏中存在共定位,并呈簇状聚合分布。在中性粒细胞活化过程中,ERp72能切割CD11b亚基的“thigh”和“genu”结构域之间的C654-C711二硫键,促进还原性巯基的暴露,推动整合素构象的改变。采用高灵敏的生物膜力学探针技术BFP进一步证实,ERp72能够直接增强Mac-1对其配体的结合力。在肺损伤炎症模型中,髓系敲除ERp72可显著减轻LPS诱导的急性肺损伤,减轻中性粒细胞的浸润、渗出和组织损伤,并提高小鼠的存活率。
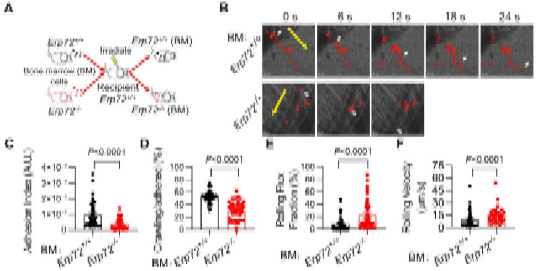
图-睾提肌微血管活体成像
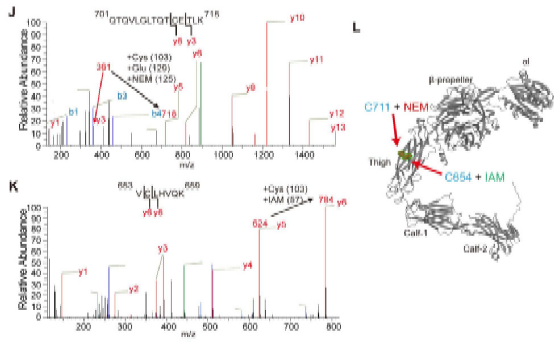
图-质谱鉴定二硫键位点
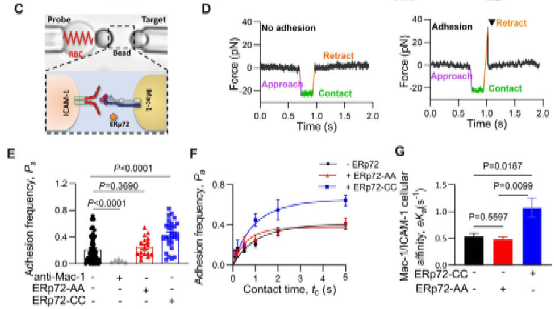
图-生物膜力学探针BFP技术
该研究发现了调控中性粒细胞募集的新机制和新靶点,揭示了ERp72催化的二硫键重排在整合素Mac-1活性调控中的重要作用,发现C654-C711是影响Mac-1构象的重要变构二硫键。该研究提示胞外ERp72可能是治疗中性粒细胞相关血管炎症的新靶点。
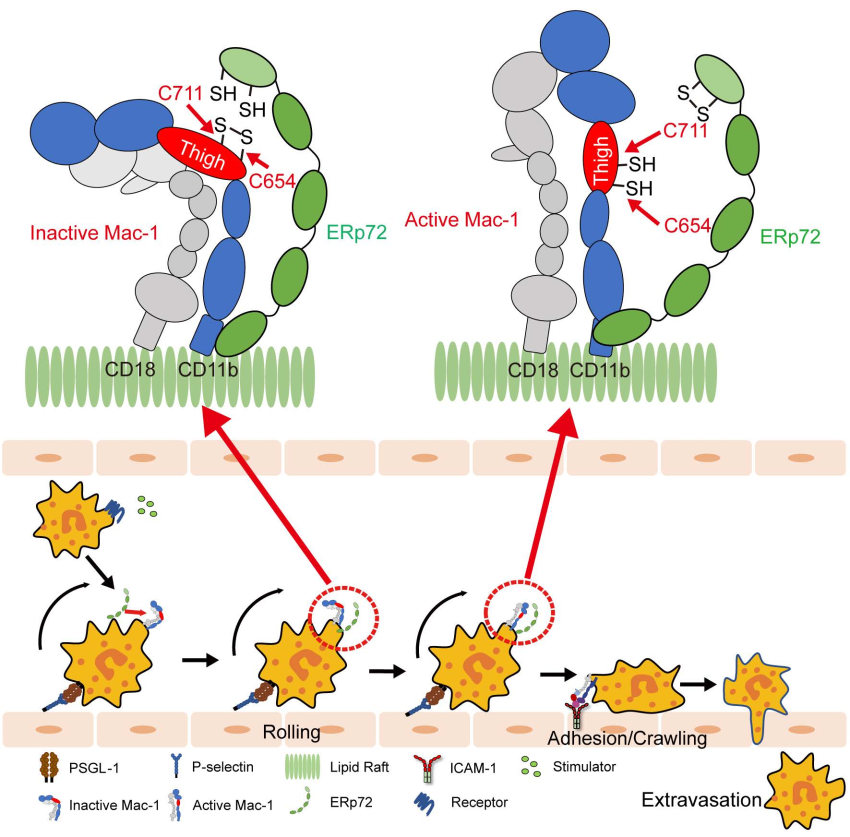
图-研究机制图
nb88新博唯一官网2019级博士生李尧丰、副教授徐旭林为论文共同第一作者,方超教授为本论文通讯作者。本研究得到了悉尼大学Arnold Ju教授等合作者的大力支持。方超教授课题组长期致力于血栓、止血和血管生物学(Thrombosis, Hemostasis and Vascular Biology)研究,采用荧光活体成像等前沿技术,研究血小板、白细胞以及内皮细胞之间的相互作用,并探索药物的药理学机制。近期的系列研究工作揭示了巯基异构酶在血栓形成及血栓炎性的作用,为开发安全高效的抗血栓药物提供了新的靶点和多种先导化合物(JACS 2023; Br J Pharmacol 2023; Br J Pharmacol 2021; Pharmacol Res 2021; Pharmacol Res. 2020),相关研究工作已获得发明专利授权2项。
该研究获得了国家自然科学基金重大研究计划、科技部国家重点研发计划、美国血液学会国际合作项目以及湖北省杰出青年基金等项目的资助。
论文链接:https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.319771
 学院官方微信
学院官方微信