
生物大分子,如蛋白质等,可以通过相分离形成无膜凝聚体,这些凝聚体在细胞内起着非常重要的作用,如传递细胞信号、形成细胞器、调控基因转录等。然而,一个关键的问题是:信号蛋白能否通过形成凝聚体来抵抗蛋白酶体的降解,从而变得更稳定,并更持久地发挥其生物学功能?
2024年1月10日,华中科技大学nb88新博唯一官网孙书国教授团队在《Nature Chemical Biology》期刊上发表题为“LATS2 condensates organize signalosomes for Hippo pathway signal transduction”的研究论文。该研究发现在细胞脱附(detachment)引发的F-actin胞质骨架重组的过程中,Hippo信号通路核心蛋白激酶LATS2从黏着连接上释放并在胞浆中形成凝聚体,该凝聚体招募Hippo信号通路中的重要组分形成Hippo信号体,促进Hippo信号通路的激活、YAP的失活和细胞的失巢凋亡;同时,LATS2通过凝聚体的形成,以物理区隔的方式使其避免E3连接酶 FBXL16引起的泛素化依赖的降解,因此变得更稳定。相反, 在恶性肿瘤中, FBXL16的扩增抑制了LATS2的凝聚体的形成进而导致细胞失巢凋亡抵抗和肿瘤的进展。
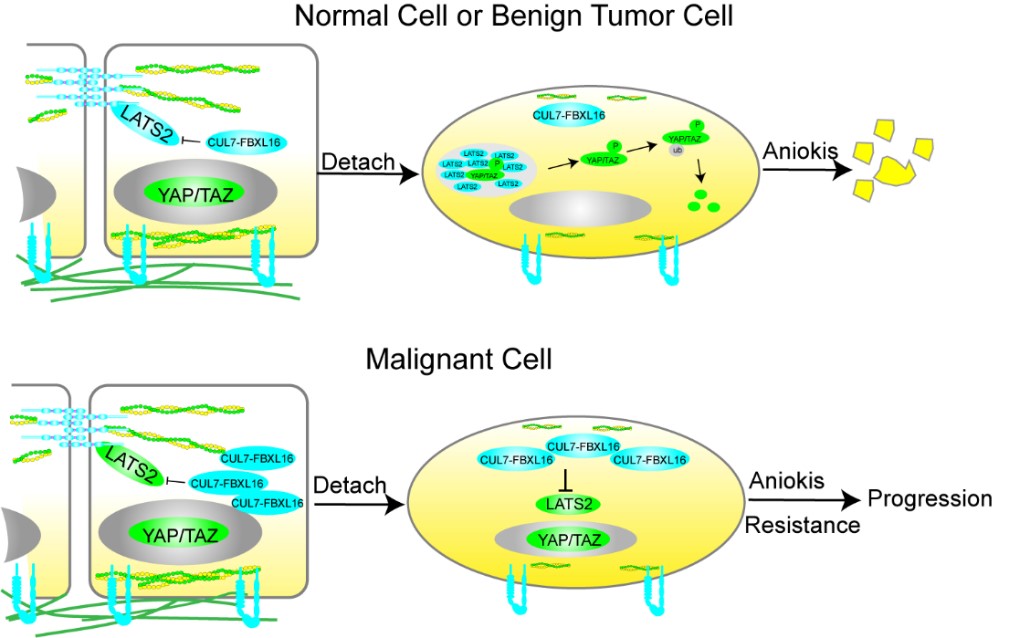
图: LATS2蛋白凝聚体招募Hippo信号体介导YAP/TAZ失活并促进肿瘤进展的模式图
高度保守的Hippo信号通路在许多生物学过程中扮演着重要角色,如器官尺寸控制,肿瘤的发生、发展和耐药等。该信号通路不仅可以响应生化信号,还能感知机械力和胞质骨架的变化。然而,胞质骨架如何调节Hippo信号通路,以及核心激酶LATS1/2在这个过程中的定位和动态变化,尚未被完全阐明。本研究发现,当细胞脱附和胞质骨架发生重组时,原本在细胞黏着连接上分布的LATS2蛋白会脱离并在胞浆中呈颗粒状分布,形成相分离凝聚体,且伴随LATS2蛋白水平显著增加和YAP完全失活。有趣的是,即使表达只有相分离能力而失去了激酶结构域的LATS2N片段(1-667氨基酸),YAP也能被完全失活,这和传统的去掉激酶结构域后出现显性负抑制(Dominant Negative)效应相反。原因是LATS2N形成的凝聚体招募了内源的LATS2导致了YAP的失活,且伴随内源的LATS2的蛋白水平上升。以上研究表明,当内源的LATS2以凝聚体的形式组织时比均匀分布活性更强,同时蛋白更稳定,提示凝聚体可以保护蛋白不被蛋白酶体降解。通过筛选,本研究鉴定到E3泛素连接酶FBXL16可以泛素化降解LATS2,且发现在侵袭性乳腺癌组织中存在FBXL16的高频扩增并与YAP上调呈现正相关,提示其在癌症中的关键作用。进一步研究结果证明FBXL16上调极大地抑制了LATS2蛋白凝聚体的形成进而促进细胞失巢凋亡抵抗和肿瘤的进展。总的来说,这项研究揭示了LATS2如何通过形成凝聚体来稳定自身并促进Hippo信号通路的激活。这为理解细胞信号转导和癌症发生、发展提供了新的视角。
论文第一完成单位为华中科技大学nb88新博唯一官网,孙书国教授为本文的通讯作者,华中科技大学nb88新博唯一官网博士生秦敏为第一作者。
 学院官方微信
学院官方微信