
nb88新博唯一官网王玉刚教授课题组和郭雨松教授课题组近年来致力于组蛋白修饰及其分子基础的相关研究。他们认为KAT2A选择酰基CoA受到酰基链的长度和静电特性以及KAT2A的替代底物结合口袋的共同影响,为KAT2A选择酰基CoA揭示了重要的分子基础。相关研究结果以“Molecular Basis of KAT2A Selecting Acyl-CoA Cofactors for Histone Modifications”为题发表在Research上。
作为一种重要的表观调控机制,组蛋白翻译后修饰可以调节包括基因转录、染色质动态结构、DNA损伤修复、氧化应激、细胞代谢、细胞周期、衰老、血管生成等关键的生物学过程。异常的修饰可导致肿瘤、代谢性疾病、自身免疫性疾病等。组蛋白乙酰化修饰是最早被发现且目前研究最为广泛的组蛋白翻译后修饰之一。近十年来,随着基于质谱技术的蛋白质组学的发展,新型的组蛋白赖氨酸酰基化修饰被陆续鉴定出来,包括丙酰化、丁酰化、丙二酰化、琥珀酰化、戊二酰化、巴豆酰化和2-羟基异丁酰化等。短链酰基CoA是组蛋白酰化修饰反应的修饰基团供体,由于短链酰CoA分子之间的化学结构相似性,越来越多的研究提出并证明乙酰转移酶利用不同的酰基CoA 催化多种类型的组蛋白酰化修饰。赖氨酸乙酰转移酶2A(KAT2A,也称为GCN5)是GCN5相关N-乙酰转移酶(GNAT)超家族的成员。研究表明KAT2A具有组蛋白乙酰转移酶(HAT)、琥珀酰转移酶、丙酰转移酶和丁酰转移酶的活性,是一种多能组蛋白酰基转移酶。然而,KAT2A选择酰基CoA底物进行组蛋白修饰的分子基础尚不明确。
在之前的研究中他们证明琥珀酰CoA和乙酰CoA在KAT2A的催化域中占据相似的结合位点,琥珀酰CoA末端指向一段柔性结构loop3的末端,loop3中的第645位酪基酸残基(Tyr645)在KAT2A对琥珀酰CoA和乙酰CoA的选择性结合中发挥重要作用。以往的研究认为酰基链较长、带电荷或带支链的酰基CoA被酰基转移酶利用的效率较低。然而,琥珀酰CoA是一种带电和支链的酰基CoA,但KAT2A的琥珀酰转移酶活性比其乙酰转移酶活性更高。虽然琥珀酰CoA比丙二酰CoA大,但KAT2A可以利用琥珀酰CoA而不是丙二酰CoA来修饰核小体(图1)。这表明,KAT2A在选择酰基CoA底物方面有一个替代机制。

根据酰基链的末端是否有一个羧基,所研究的酰基CoA被分成两类:乙酰CoA、丙酰CoA和丁酰CoA是I型CoA分子;丙二酰CoA、琥珀酰CoA和戊二酰CoA是II型CoA分子。他们发现上述酰基CoA分子都结合于同一个底物结合口袋(图2),都有可能被KAT2A利用来修饰组蛋白。那么KAT2A是如何选择酰基CoA进行组蛋白修饰的呢?
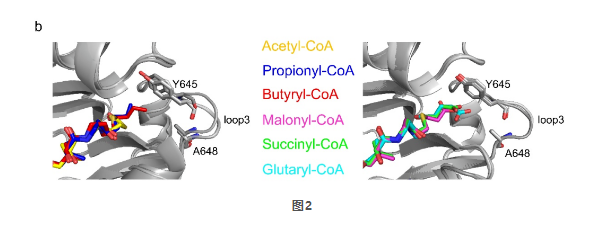
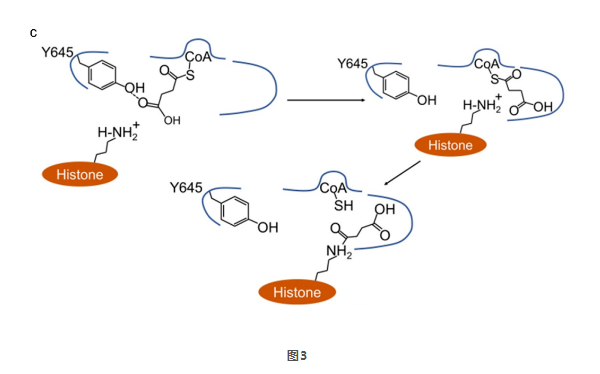
根据高分辨率结构信息,他们提出了酰基链翻转和替代口袋机制解释丙酰化和丁酰化的发生。琥珀酰-CoA是II型CoA分子中的一个例外。琥珀酰基末端的羧基与KAT2A的Tyr645形成氢键,这可能使羧基的电子密度重新分配到Tyr645残基上,从而阻止琥珀酰基与底物赖氨酸残基中带正电的ε-氨基之间的静电作用,使琥珀酰基链类似于中性酰基链,因此能够被翻转到替代口袋中进行琥珀酰化过程(图3)。而丙二酰CoA和戊二酰CoA的酰基链长短不合适,无法与Tyr645残基形成氢键,因此丙二酰/戊二酰CoA与赖氨酸残基之间的静电作用阻止了丙二酰/戊二酰化。他们认为KAT2A选择酰基CoA受到酰基链的长度和静电特性以及KAT2A的替代底物结合口袋的共同影响,为KAT2A选择酰基CoA揭示了重要的分子基础。
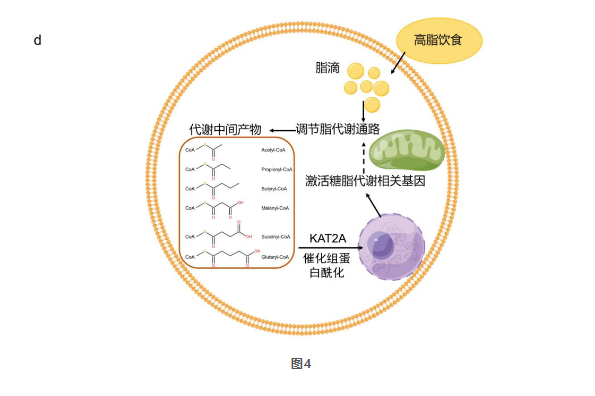
酰基CoA类代谢物是细胞代谢过程中重要的物质和能量传递媒介,同时也作为赖氨酸酰基化修饰基团供体,广泛地参与细胞内蛋白质的翻译后修饰过程,将细胞的代谢状态“翻译”成细胞内的蛋白质修饰图谱,进而反馈调控细胞的代谢网络。在本研究中,他们发现KAT2A能够通过发挥酰化修饰功能调控相关基因的转录,进而影响细胞脂质代谢。组蛋白的酰化修饰受酰基CoA浓度调节。当细胞出现糖脂代谢异常时,KAT2A通过其多能酰基转移酶活性接收多种异常酰基CoA代谢产物的信号并将其“翻译”为体内多种组蛋白酰基化修饰图谱,并通过在多个基因的启动子区域催化不同种组蛋白酰基化修饰来调控基因表达进而调控细胞的代谢状态(图4),与疾病的发生和进展密切相关。
这项研究证实了细胞代谢与组蛋白酰化修饰存在调控网络,但二者之间具体的联系目前并不明确。例如:在不同的代谢状态下,各种酰基CoA所占的比例、KAT2A对酰基CoA的偏好性以及如何对组蛋白赖氨酸残基进行精准修饰进而调控基因表达?各种短链酰基CoA如何进入细胞核?对于异常酰基化修饰导致的疾病,是否可通过精准干扰相应酰基CoA的合成(入核)或分解达到治疗疾病的效果?因此,组蛋白酰化修饰的功能、调节机制及代谢调控网络值得更深入的研究,这将为相关疾病的发病机制及治疗提供新的见解。
 学院官方微信
学院官方微信