阿尔茨海默病(Alzheimer's disease, AD)是主要的痴呆类型之一。其主要的病理特征是β淀粉样蛋白形成的斑块和过度磷酸化tau蛋白形成的神经纤维缠结,并伴有突触功能障碍和神经炎症反应。在临床上,AD最重要的表现是进行性认知能力下降。在大脑中,神经元和胶质细胞之间的细胞通讯在协调大脑生理功能方面起着关键作用。然而,神经元中病理性tau是否会干扰星形胶质细胞,调控AD的疾病发生仍不清楚。
最近,一些研究揭示了腺苷及其受体在各种神经系统疾病的神经调节和神经保护作用中的关键作用。已知存在4个腺苷受体,分别是A1、A2A、A2B和A3。腺苷受体A1(A1R)是一种抑制性腺苷受体,在大脑中表达量较高。给予咖啡因(一种非选择性A1R拮抗剂),可以减轻Aβ病变,对AD有保护作用。此外,敲除A1R可以改善老年小鼠的炎症反应[11]。但A1R在介导AD认知障碍和突触损伤的作用机制仍不明确。
2023年4月21日,华中科技大学朱铃强教授团队在Science Advances上发表题目为Tau pathology epigenetically remodels the neuron-glial cross-talk in Alzheimer's disease 的文章,发现了病理性Tau蛋白通过影响神经元A1R/Lcn2通路,调控神经元-星形胶质细胞的Cross-talk,参与AD认知障碍和突触损伤,为AD治疗提供了新靶点。

朱铃强团队的研究证实,A1R蛋白在AD患者、AD病人来源的iPSC、3×Tg和P301L-AD模型小鼠中上调表达,并且A1R蛋白表达水平与磷酸化的Tau蛋白具有正相关性。但其mRNA表达在AD中并无变化,经过动物体内和细胞体外的实验研究,发现磷酸化Tau可以通过Mef2c/miR-133a-3p,在转录后水平表观遗传调控A1R的表达。
在野生型C57小鼠的海马神经元中特异性过表达A1R后,小鼠出现学习记忆障碍和突触损伤,并发现星形胶质细胞过度活化和炎症因子的高量表达;此外,在3×Tg小鼠海马神经元特异性干扰A1R后,可以缓解其记忆障碍和突触损伤,过度活化的星形胶质细胞被抑制,炎症因子的表达量也明显降低,同时Aβ生成和Tau磷酸化水平也都明显降低。
随后原代细胞实验发现,用过表达A1R的原代神经元的培养基,处理原代星形胶质细胞,导致其过度活化。利用iPSC技术,用AD病人iPSC神经元培养基预处理的星胶,再用此星胶和神经元共培养,结果发现,与对照iPSC神经元培养基预处理的星胶相比,AD病人iPSC神经元培养基预处理的星胶能明显降低神经元sEPSCs幅度。
进一步通过转录组测序发现,A1R敲除小鼠海马中,脂质运载蛋白2(Lipocalin-2, Lcn2)表达显著降低,并发现Lcn2在3×Tg小鼠上调,且在过表达A1R的原代神经元培培养基中含量增加。进一步敲除3×Tg小鼠中A1R,发现AD中过度活化的星形胶质细胞被抑制,Lcn2和炎症因子的表达都降低,认知障碍和突触损伤得到缓解。
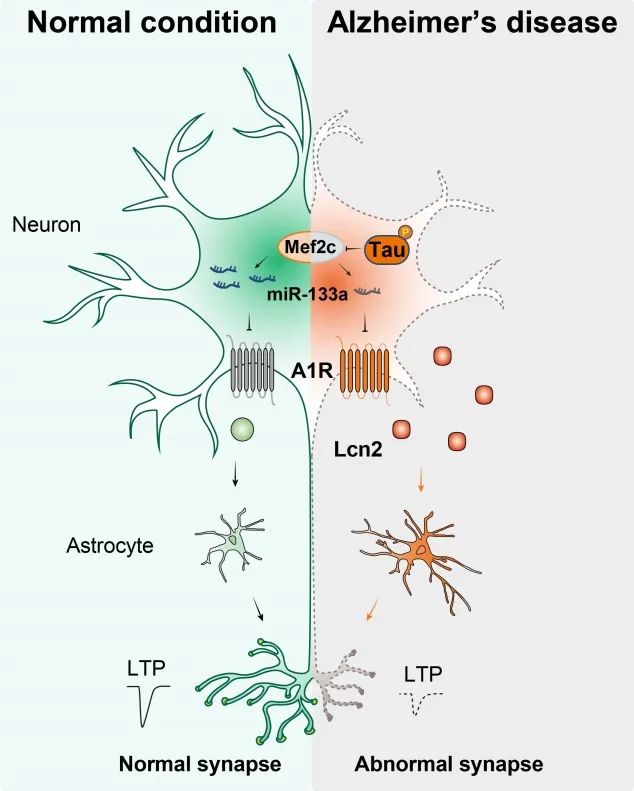
图1 工作机制图
综上,在AD神经元中病理性tau蛋白表观遗传学调控A1R的表达,导致神经元表达和分泌Lcn2明显增加,从而激活星形胶质细胞,诱发AD神经炎症反应,最终导致突触损伤和认知功能障碍(图1)。
华中科技大学nb88新博唯一官网病理生理学系2017级博士研究生周兰庭、医学遗传学系刘丹教授和附属同济医院神经内科康慧聪主任为该论文的共同第一作者,朱铃强教授和鲁友明教授为论文的共同通讯作者。
论文链接:http://doi.org/10.1126/sciadv.abq7105
 学院官方微信
学院官方微信