2022年12月6日,nb88新博唯一官网于洪军教授团队在 Cell Discovery 杂志上发表了文章 Structures and mechanism of chitin synthase and its inhibition by antifungal drug Nikkomycin Z。该研究解析了酿酒酵母几丁质合成酶1(CHS1)多种状态的高分辨率冷冻电镜结构,阐明了真菌几丁质合成的机制,揭示了抗真菌药物尼克霉素Z作用的分子机理,为抗真菌药物的改善和开发提供了理论基础。

真菌严重影响人类健康,全世界有超过10亿人口受到真菌感染的影响,每年有近两百万人死于侵袭性真菌感染,特别是对免疫功能受损人群以及新冠(COVID-19)患者,会导致极高的病死率1。广谱抗生素、免疫抑制剂、类固醇等药物的广泛使用,使得真菌感染呈上升趋势。而耐药性真菌菌株的出现,给治疗真菌感染患者带来了更为严峻的挑战2。因此,迫切需要开发多种新型抗真菌药物以应对当前需求。几丁质是真菌细胞壁重要的特有成分,由几丁质合成酶CHS催化合成并跨细胞膜转运至胞外参与细胞壁的形成。CHS及其同源物在维持真菌细胞结构功能完整性方面发挥重要作用,是抗真菌药物开发的理想靶标3。尼可霉素Z(Nikkomycin Z)是靶向几丁质合成酶CHS的一类核苷肽类抗真菌药物,对于球孢子菌、皮炎芽生菌、组织胞浆菌以及孢子丝菌等具有强力的杀菌作用,与棘白菌素联合用药后对念珠菌、烟曲霉菌等引起的感染有较好的治疗效果3。对于这一重要的抗真菌药物靶点,CHS参与的几丁质合成机制以及尼可霉素Z对CHS的靶向抑制机制,都尚不清楚。
该研究报道了几丁质合成酶1(CHS1)特殊的二聚体功能形态(图1a)。胞质侧的GT-domain和三个特征的界面螺旋(IF1-3)围绕形成了几丁质合成的催化反应中心,其中D717、R759、W760是关键的催化氨基酸,在多种致病真菌中高度保守,显示了几丁质合成的保守机制。在跨膜结构域中,跨膜螺旋TM1, TM3-4和TM6围绕成了中空的跨膜孔道,在胞质侧与催化反应中心相连,形成了几丁质跨膜转运的通道(图1b)。通过分析CHS1与药物复合物的高分辨率结构,研究人员发现了抗真菌药物尼克霉素Z与CHS形成了特异性的广泛相互作用,其中,药物的核苷部分占据CHS1的催化反应中心而药物的3-吡啶醇基团占据了几丁质转运通道的入口,这种特定的药物作用模式极为有效的抑制了几丁质的合成(图1c-d)。综上,该研究揭示了真菌几丁质合成的分子基础,包括关键的几丁质合成催化反应中心以及跨膜转运通道,阐明了抗真菌药物尼克霉素Z抑制几丁质合成的独特作用机制,为新型抗真菌药物的开发提供了理论基础。
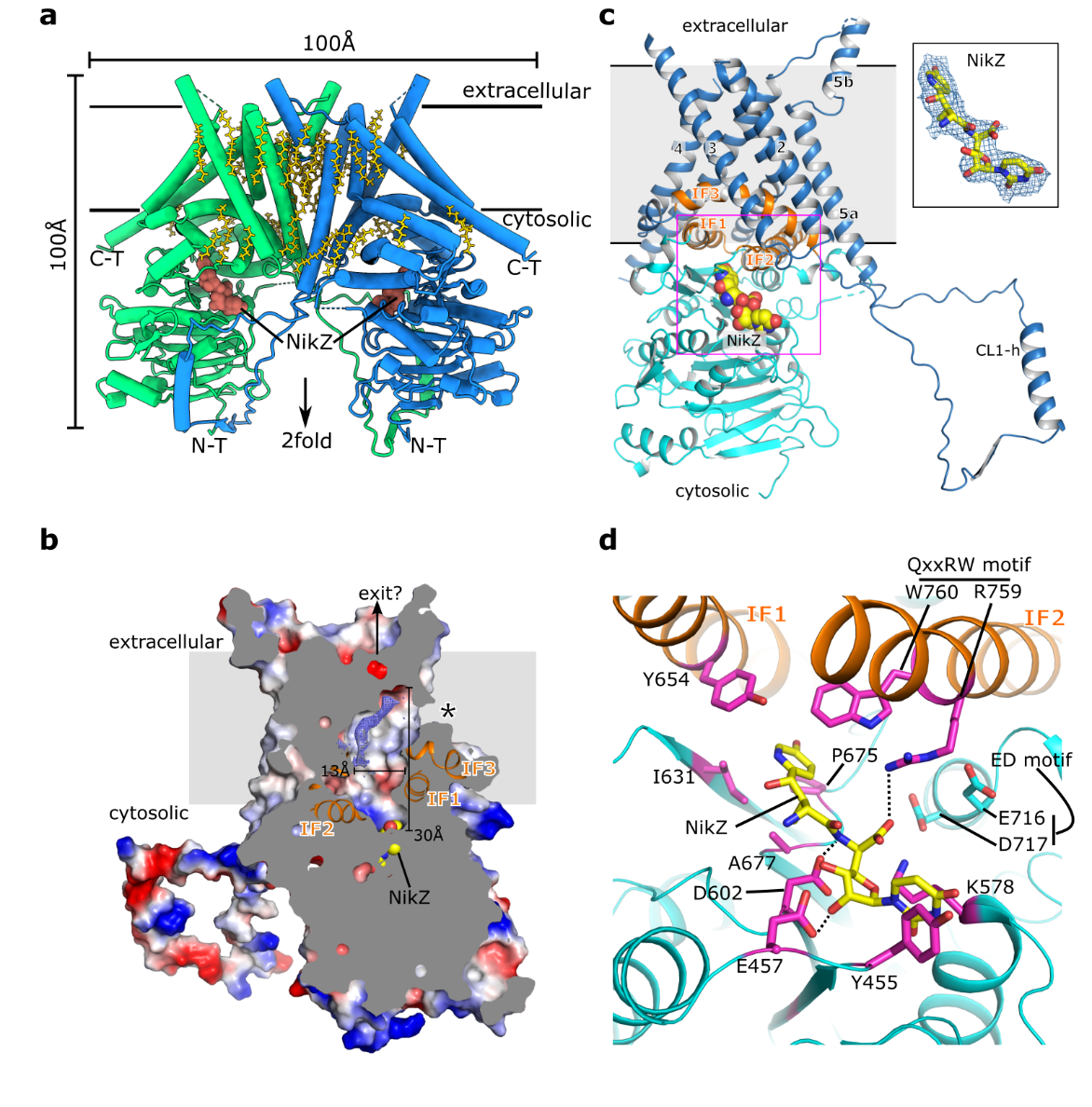
图1 CHS1整体结构及与抗真菌药物尼克霉素Z (NikZ)的相互作用模式
本研究由nb88新博唯一官网生化系于洪军教授、病原生物学系张敏副研究员,联合南方科技大学生命科学院张明杰院士、刘晓天副研究员合作完成,华中科技大学为第一完成单位。nb88新博唯一官网博士研究生吴亚楠、张敏副研究员和硕士研究生杨依争为共同第一作者。该研究获得了国家自然科学基金面上项目、青年项目、生物大分子动态修饰与化学干预重大研究计划培育项目的资助。
 学院官方微信
学院官方微信