2022年7月15日,华中科技大学同济医学院nb88新博唯一官网病理生理学系朱铃强教授团队在国际学术期刊《分子精神病学》(Molecular Psychiatry)(Nature Index 入选期刊)在线发表题为 Social isolation reinforces aging-related behavioral inflexibility by promoting neuronal necroptosis in basolateral amygdala 的研究论文。该研究首次揭示了老年动物行为灵活性障碍的分子机制,并且确定了独居的生活方式会促进老龄行为灵活性的发展,同时还提出了可能的干预策略。

行为灵活性是大脑执行控制系统的核心适应性能力,是根据环境变化灵活调整行为的能力。它使个人、机构和社会能够快速应对瞬息万变的外部环境。行为灵活性促进了成年期的执行功能发展,并可以减轻衰老对认知能力的影响。大量研究表明,行为灵活性的神经生物学基础是一些关键脑区能够灵活地配置自身以响应不断变化的需求。一致衰老的特点是认知功能逐渐下降,包括行为灵活性,然而,衰老过程中行为灵活性受损的潜在机制尚不清楚。这项研究利用快速衰老的SAMP8小鼠作为模型,首次报道了5月龄SAMP8小鼠基底外侧杏仁核 (Basolateralamygdala,BLA) 神经元程序性坏死引起了该脑区的神经元活动降低,并与衰老过程中行为灵活性受损密切相关。 Nec-1s(一种特定的程序性坏死抑制剂)的应用逆转了 SAMP8 小鼠行为灵活性的损害。利用高通量测序,该团队进一步揭示糖原合酶激酶3α (Glycogen synthase kinase 3α,GSK-3α) 的丢失与老年小鼠 BLA 和老年食蟹猴 (Macacafascicularis) 的杏仁核中的程序性坏死的激活密切相关。此外,GSK-3α 的基因缺失或敲低导致野生型小鼠的程序性坏死和行为灵活性受损,而在老龄小鼠BLA中过表达GSK-3α能逆转老年小鼠程序性坏死的激活和行为不灵活性。最后,研究发现 GSK-3α 的缺失导致 mTORC1 信号通路的激活,从而促进 RIPK3 依赖性程序性坏死。由于老龄人群存在较多的独居现象,研究人员进一步发现独居能加速衰老模型小鼠程序性坏死的激活和行为灵活性受损的发生,而干预GSK-3α的缺失、抑制mTORC1信号通路或抑制细胞程序性坏死均能有效逆转上述异常(见插图)。总之,该研究不仅揭示了老年动物行为灵活性障碍的具体分子机制,而且阐明独居是老年认知灵活性障碍的高危因素,并且基于分子机制提出可能的干预策略。
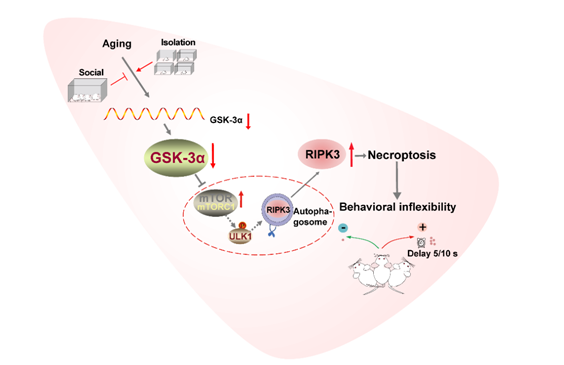
插图:独居通过促进BLA神经元程序性坏死加速老龄行为灵活性障碍
华中科技大学nb88新博唯一官网博士后张娟,华中科技大学nb88新博唯一官网医学遗传学系刘丹教授和华中科技大学协和医院神经外科副主任医师付朋为该论文的共同第一作者;华中科技大学同济医学院nb88新博唯一官网病理生理学系朱铃强教授为论文的通讯作者。该研究获得科技创新2030“脑科学与类脑研究”重大项目,国家自然科学基金重点项目和国家青年拔尖人才计划的资助。
原文链接:https://www.nature.com/articles/s41380-022-01694-5
 学院官方微信
学院官方微信