11月15日, 临床医学知名杂志“Journal of Clinical Investigation”(IF=13.25)在线发表了nb88新博唯一官网免疫学系杨想平教授和病理学系王国平教授课题组的合作研究成果:“Lactate inhibits ATP6V0d2 expression in tumor-associated macrophages to promote HIF-2α-med-iated tumor progression”。
肿瘤目前被认为是异常发育的复杂类器官, 包含大量的异常血管结构, 同时由于肿瘤细胞快速生长并利用糖酵解获取能量, 消耗大量活性氧, 故形成一个低氧微环境。肿瘤微环境中含有大量细胞外基质、血管结构以及肿瘤细胞、基质细胞、成纤维细胞, 同时也包括大量浸润的免疫细胞, 如CD8+T细胞, B细胞和大量的巨噬细胞, 又称为肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)。近年随着肿瘤免疫治疗特别是Car-T和免疫节点治疗在临 床 上 的成功, 深入研究肿瘤微环境对免疫细胞功能调节机制具有重要的基础研究和临床意义。巨噬细胞在不同微环境和疾病条件下分化成不同表型, 并获得其组织特异性功能, 具有很强异质性。目前一般认为, TAMs具有促肿瘤生长功能。但TAMs在肿瘤微环境中如何获得特异性促肿瘤功能机制并不清楚。
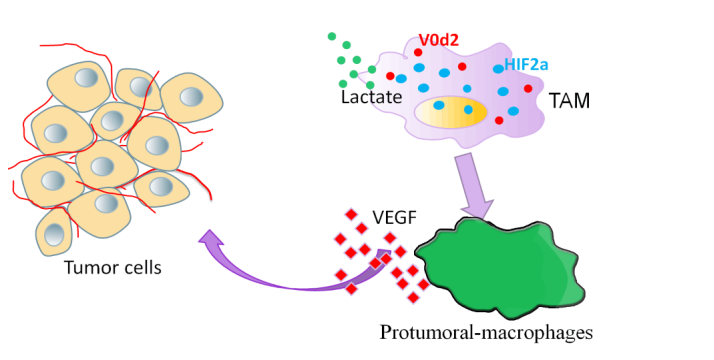
囊泡水解酶是一个由14个亚单位组成的大分子复合物, 主要介导细胞器酸化。该研究发现, 囊泡水解酶ATP6V0d2亚基特异表达于巨噬细胞。肿瘤条件性培养基能特异下调巨噬细胞溶酶体上的ATP6V0d2亚基表达, 而不影响其它亚基表达。科研团队进一步揭示, 肿瘤微环境中肿瘤细胞糖酵解所产生的乳酸通过激活mTOR, 从而磷酸化转录因子TFEB并抑制其核转位, 从而抑制TFEB靶基因Atp6v0d2表达。在小鼠模型中, 皮下移植的肿瘤细胞在Atp6v0d2-/-小鼠中生长更快, 尾静脉注射的LLC肺腺癌肿瘤细胞向肺转移结节在Atp6v0d2-/-小鼠中明显增多, 血管增多, VEGF增多和巨噬细胞向促肿瘤表型极化增强, 提示ATP6V0d2能抑制肿瘤生长与转移。
HIF-1α和HIF-2α为调控血管生成和巨噬细胞极化的重要转录因子, 科研团队发现ATP6V0d2能增强溶酶体介导的HIF-2α降解而不影响HIF-1α的稳定性, 敲除ATP6V0d2后, 在厌氧和常氧条件下, HIF-2α的稳定性明显增强, 但HIF-1α的稳定性无明显变化。更为重要的是, 杨想平课题组和病理系王国平教授团队合作发现, 在人的临床肺腺癌患者组织中, ATP6V0d2和HIF-2α的表达与患者存活时间分别呈正相关和负相关, 显示肿瘤细胞能够通过其代谢产物调控巨噬细胞ATP6V0d2表达, 从而抑制ATP6V0d2介导的HIF-2α溶酶体降解, 从而使肿瘤相关巨噬细胞TAMs在肿瘤微环境中编程重组为促进肿瘤生长的免疫细胞。
该研究不仅揭示了肿瘤微环境中肿瘤细胞与免疫细胞相互调节新机制, 还发现ATP6V0d2表达高低可以作为肺腺癌重要的预后标志, 具有重要的临床意义。
nb88新博唯一官网免疫学系2016级博士研究生刘娜, 博士后骆静和病理系况东老师为该文共同第一作者,杨想平教授与王国平教授为共同通讯作者,华中科技大学为论文的第一发表单位。该课题组项目受到国家自然科学基金面上项目、973项目、华中科技大学交叉培育项目和人才计划的资助。
论文链接:https://www.jci.org/articles/view/123027

 学院官方微信
学院官方微信